本文轉自“中國器審”公眾號
2023年1月27日,FDA和加拿大衛生部共同啟動eSTAR試點工作。2023年6月9日,eSTAR係統開放,可用於向CDRH提交Pre-submission。自2023年10月1日起,除非獲得豁免,否則所有510(k)相關內容必須使用eSTAR係統提交。自2025年10月1日起,De Novo申請也需使用eSTAR進行提交。該係統作為行業指導性提交準備工具,旨在提高提交一致性及審查過程的效率。
PART 01 eSTAR係統概述
1.介紹。eSTAR係統是一種交互式PDF表格,可指導申請人通過準備全麵的醫療設備提交過程。目前,eSTAR係統為自願使用,旨在通過幫助申請人確認提交質量和用於上市前確認的全麵數據,來提高大部分醫療器械的申請提交質量。同時,借助標準化的格式,提交者可以確保其提交內容已完成,並且FDA可以更有效地進行上市前審查,以推動安全、有效和高質量的醫療器械申報效率提升。由於使用自動驗證,FDA不打算在eSTAR中進行RTA審查提交。
2.特點。此模板特點主要有,自動化(例如,表單構造和自動填充);與FDA內部審核模板互補的內容和結構;集成多種資源(例如,指南和數據庫);遞交內容結構具有指導性;自動驗證(不需要進行RTA 審查)。
3.使用人群。eSTAR是免費的,所有希望提交510(k)、De Novo和Pre-Submission到CDRH以及提交510(k)到CBER的醫療設備申請人可以自願使用。eSTAR目前也可用於組合產品。
PART 02 eCopy\eSubmitter\eSTAR對比
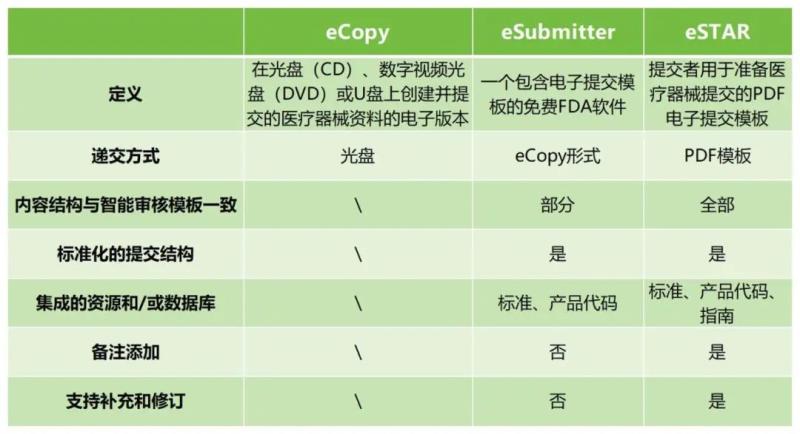
PART 03 eSTAR優勢
1.遞交文件表單自動化,整合指南和標準庫。在eSTAR PDF遞交模板中嵌入了FDA 510(k)遞交要求的表格,實現表單構建和自動填充,規範了填寫內容和形式,減少前期文件上傳、填寫錯誤,方便後續自動驗證。同時,eSTAR具有自動識別填充的功能,能根據產品的描述,識別哪些是必須提供的信息,也能根據產品特點提供適宜的指導文件、資源或數據,這有利於提高企業申請資料水平。
2.減少RTA 審查環節,提高審查效率。使用eCopy的時候,容易因為文件中簡單的前後不一致等小問題,導致審核暫停並重新修改文件後快遞提交給FDA,使得510k審核周期會因為一些非實質等效問題而拖延幾個月。而eSTAR通過自動化的表單,來實現自動驗證,FDA不再對eSTAR進行RTA審查,直接進入SE等效性審查,大大縮短審核時間以及eCOPY遞交時間。
3.與CDRH內部審查模板互補的內容結構。eSTAR表單與CDRH內部審查互補,並且能夠添加備注,大大地提高審核的效率和質量。同時,基於eSTAR是一個PDF模板的本質,FDA接收到的申請材料格式一致,也方便了審核。
eSTAR自動化、高集合、結構化的PDF表單能夠提高申請資料的質量和一致性,減免RTA環節,從而提高審核效率。
PART 04 我國eRPS係統
2019年6月24日,我國現有eRPS係統正式啟用,eRPS係統與醫療器械技術審評信息係統密切關聯,實現了資料的電子審閱和流轉。eRPS係統的正式使用一是實現無紙化辦公,申報資料無需郵寄、無需排隊,提高了流轉效率;二是實現係統化資料,傳統紙質資料結構層次不立體,審評較難查閱,通過設置申報資料填寫結構,立體展現產品研發思路;三是實現規範化管理,通過全過程留痕、全流程監管,智能分配申報資料,保障資料安全性,優化審評審批流程。我國eRPS係統與FDA的eSubmitter係統更為類似,主要目的為實現注冊申報資料的電子化流轉進程。
PART 05 基於eSTAR係統的思考
FDA的eSTAR係統覆蓋了申報510k的產品,該類產品主要為低風險及中風險的產品,並且有同類型已上市產品。而我國eRPS係統覆蓋了三類醫療器械申報,其中包含了植入等高風險產品,需進行更為嚴格的上市前審批。基於我國與FDA監管體係的差異,eSTAR係統有幾點優勢可為我國eRPS係統優化提供思路。
1.參照審評思路優化表單形式。eSTAR PDF遞交模板除了能夠實現表單構建和自動填充,同時采用問答式的表單,使申請人在上傳相關資料的時候,能夠進一步梳理自己的申報思路和資料提交的係統性、完整性,更好的審核申報內容。
2.整合多方數據庫於同一平台。eSTAR嵌入了標準庫等數據庫,企業能夠在模板中選擇查看相應的標準及指導文件,減少了企業在不同網站查找相應文件的過程,有利於提高企業資料準備效率及準確性,進一步提升申請資料水平。
3.分產品開展立卷審查工作。參考eSTAR不再進行RTA審查的形式,建議我國可在產品申報階段設置選項,選擇不同的申報路徑,來區分立卷審查的方式,減少審評的壓力,聚焦重點產品的審查工作。
國家藥監局高度重視智慧監管工作推進,eRPS係統如何更好的將注冊申報相關資源(如標準、導則庫)整合,通過規範優化係統流程來加強指引,eSTAR係統的推出或提供新思路。
PART 06 定義解釋
1.eSTAR:Electronic Submission Template and Resource,提交者用於準備醫療器械提交的PDF電子提交模板;
2.CDRH:Center for Devices and Radiological Health器械和輻射健康中心;
3.Pre-submission:申請人自願在產品注冊之前與FDA的溝通;
4.RTA:Refuse to Accept,拒絕接受指南,解釋CDRH預期用以評估是否可以接受510(K)遞交進行審核的程序和標準;
5.eSubmitter:一個包含電子提交模板的免費FDA軟件;
6.eCOPY:在光盤(CD)、數字視頻光盤(DVD)或U盤上創建並提交的醫療器械資料的電子版本;
7.SE:等效性審核。
參考文獻:
1.https://www.fda.gov/medical-devices/how-study-and-market-your-device/voluntary-estar-program
本文轉自“中國器審”公眾號
2023年1月27日,FDA和加拿大衛生部共同啟動eSTAR試點工作。2023年6月9日,eSTAR係統開放,可用於向CDRH提交Pre-submission。自2023年10月1日起,除非獲得豁免,否則所有510(k)相關內容必須使用eSTAR係統提交。自2025年10月1日起,De Novo申請也需使用eSTAR進行提交。該係統作為行業指導性提交準備工具,旨在提高提交一致性及審查過程的效率。
1.介紹。eSTAR係統是一種交互式PDF表格,可指導申請人通過準備全麵的醫療設備提交過程。目前,eSTAR係統為自願使用,旨在通過幫助申請人確認提交質量和用於上市前確認的全麵數據,來提高大部分醫療器械的申請提交質量。同時,借助標準化的格式,提交者可以確保其提交內容已完成,並且FDA可以更有效地進行上市前審查,以推動安全、有效和高質量的醫療器械申報效率提升。由於使用自動驗證,FDA不打算在eSTAR中進行RTA審查提交。
2.特點。此模板特點主要有,自動化(例如,表單構造和自動填充);與FDA內部審核模板互補的內容和結構;集成多種資源(例如,指南和數據庫);遞交內容結構具有指導性;自動驗證(不需要進行RTA 審查)。
3.使用人群。eSTAR是免費的,所有希望提交510(k)、De Novo和Pre-Submission到CDRH以及提交510(k)到CBER的醫療設備申請人可以自願使用。eSTAR目前也可用於組合產品。

1.遞交文件表單自動化,整合指南和標準庫。在eSTAR PDF遞交模板中嵌入了FDA 510(k)遞交要求的表格,實現表單構建和自動填充,規範了填寫內容和形式,減少前期文件上傳、填寫錯誤,方便後續自動驗證。同時,eSTAR具有自動識別填充的功能,能根據產品的描述,識別哪些是必須提供的信息,也能根據產品特點提供適宜的指導文件、資源或數據,這有利於提高企業申請資料水平。
2.減少RTA 審查環節,提高審查效率。使用eCopy的時候,容易因為文件中簡單的前後不一致等小問題,導致審核暫停並重新修改文件後快遞提交給FDA,使得510k審核周期會因為一些非實質等效問題而拖延幾個月。而eSTAR通過自動化的表單,來實現自動驗證,FDA不再對eSTAR進行RTA審查,直接進入SE等效性審查,大大縮短審核時間以及eCOPY遞交時間。
3.與CDRH內部審查模板互補的內容結構。eSTAR表單與CDRH內部審查互補,並且能夠添加備注,大大地提高審核的效率和質量。同時,基於eSTAR是一個PDF模板的本質,FDA接收到的申請材料格式一致,也方便了審核。
eSTAR自動化、高集合、結構化的PDF表單能夠提高申請資料的質量和一致性,減免RTA環節,從而提高審核效率。
2019年6月24日,我國現有eRPS係統正式啟用,eRPS係統與醫療器械技術審評信息係統密切關聯,實現了資料的電子審閱和流轉。eRPS係統的正式使用一是實現無紙化辦公,申報資料無需郵寄、無需排隊,提高了流轉效率;二是實現係統化資料,傳統紙質資料結構層次不立體,審評較難查閱,通過設置申報資料填寫結構,立體展現產品研發思路;三是實現規範化管理,通過全過程留痕、全流程監管,智能分配申報資料,保障資料安全性,優化審評審批流程。我國eRPS係統與FDA的eSubmitter係統更為類似,主要目的為實現注冊申報資料的電子化流轉進程。
FDA的eSTAR係統覆蓋了申報510k的產品,該類產品主要為低風險及中風險的產品,並且有同類型已上市產品。而我國eRPS係統覆蓋了三類醫療器械申報,其中包含了植入等高風險產品,需進行更為嚴格的上市前審批。基於我國與FDA監管體係的差異,eSTAR係統有幾點優勢可為我國eRPS係統優化提供思路。
1.參照審評思路優化表單形式。eSTAR PDF遞交模板除了能夠實現表單構建和自動填充,同時采用問答式的表單,使申請人在上傳相關資料的時候,能夠進一步梳理自己的申報思路和資料提交的係統性、完整性,更好的審核申報內容。
2.整合多方數據庫於同一平台。eSTAR嵌入了標準庫等數據庫,企業能夠在模板中選擇查看相應的標準及指導文件,減少了企業在不同網站查找相應文件的過程,有利於提高企業資料準備效率及準確性,進一步提升申請資料水平。
3.分產品開展立卷審查工作。參考eSTAR不再進行RTA審查的形式,建議我國可在產品申報階段設置選項,選擇不同的申報路徑,來區分立卷審查的方式,減少審評的壓力,聚焦重點產品的審查工作。
國家藥監局高度重視智慧監管工作推進,eRPS係統如何更好的將注冊申報相關資源(如標準、導則庫)整合,通過規範優化係統流程來加強指引,eSTAR係統的推出或提供新思路。
1.eSTAR:Electronic Submission Template and Resource,提交者用於準備醫療器械提交的PDF電子提交模板;
2.CDRH:Center for Devices and Radiological Health器械和輻射健康中心;
3.Pre-submission:申請人自願在產品注冊之前與FDA的溝通;
4.RTA:Refuse to Accept,拒絕接受指南,解釋CDRH預期用以評估是否可以接受510(K)遞交進行審核的程序和標準;
5.eSubmitter:一個包含電子提交模板的免費FDA軟件;
6.eCOPY:在光盤(CD)、數字視頻光盤(DVD)或U盤上創建並提交的醫療器械資料的電子版本;
7.SE:等效性審核。
參考文獻:
1.https://www.fda.gov/medical-devices/how-study-and-market-your-device/voluntary-estar-program
往期精彩推薦 # # # # # #
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139


