近年來,隨著非洲國家的經濟發展,民眾對基礎醫療服務的需求持續提升,各國政府對於醫療衛生的費用支出也持續增長,非洲醫療衛生市場規模正在不斷擴大。目前非洲大部分國家缺乏本土醫療器械製造業,醫療器械進口依賴度高,這為我國醫療器械企業出海提供了良機。
與此同時,在“一帶一路”倡議不斷向非洲延伸以及中非“八大行動”不斷落實的背景下,中國企業投資非洲醫療器械產業有望迎來更大機遇。
INTRODUCTION
在此背景下,本期文章我們聚焦西非經濟的重要增長引擎——加納,為大家帶來加納醫療器械注冊全流程詳解。
01
法規框架
醫療器械產品注冊由加納食品和藥品管理局(Ghana FDA)嚴格把控。若想將醫療器械引入加納市場,企業必須通過加納FDA的認證流程。具體來說,加納醫療器械注冊的要求及流程主要參照以下法規和指南:
1)Public Health Act, 2012——《公共衛生法(2012)》
2)GUIDELINE FOR REGISTRATION OF MEDICAL DEVICE——《醫療器械注冊指南》
3)GUIDELINE FOR IMPORTATION OF MEDICAL DEVICES——《醫療器械進口指南》
02
分類規則
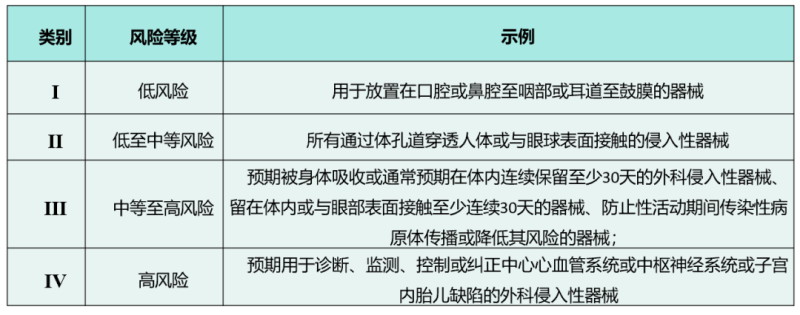
在《醫療器械注冊指南》中,加納FDA根據產品風險從低到高,將醫療器械分為Ⅰ、Ⅱ、Ⅲ、Ⅳ四個風險等級。下表列出了醫療器械的四個風險類別,企業可根據示例內容對產品類別進行大致判斷。另外在《醫療器械注冊指南》中,還列出了醫療器械分類的16條具體規則,根據這些規則可以更明確地判斷產品類別。
03
注冊遞交路徑及資料要求
在《醫療器械注冊指南》中,沒有對各產品類別的注冊路徑進行區分,而是隻分為新的注冊申請、注冊續期的申請及已注冊醫療器械的變更申請三種,注冊時需提交的資料主要包括醫療器械注冊申請表、技術文檔(器械描述和功能、符合安全和性能基本原則的證據、器械規格、設計文件、器械驗證和確認等)、質量管理體係文件、標簽和使用說明書等。

04
關於加納代理人
加納境外申請人在加納進行注冊,必須指定當地代理人(local agent),具體要求如下:
1)資質要求:在加納注冊的法人團體;具備申請人的相關授權;有能力代表申請人處理與注冊相關的事宜。
2)代理人職責:監控市場上的器械並承擔法律責任,向加納FDA通報相關問題;促進申請人與加納FDA之間的溝通;處理器械召回;為用戶提供技術支持和服務等。
' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E)
以上就是我們本期分享的加納注冊相關內容,假如您有加納注冊需求,歡迎隨時聯係我們~金飛鷹可為您提供以下專業服務:
注冊全流程服務:產品分類評估和注冊路徑規劃;資料準備、審核和遞交;與加納FDA直接溝通並及時響應客戶問詢;
本地化支持:依托加納當地戰略合作商資源,為企業提供專業代理人服務,並整合本土資源加速注冊審批流程;
質量管理服務:基於ISO 13485要求的質量管理體係建立和輔導;迎檢準備和現場支持;差距分析和整改建議;
持續合規服務:注冊續期提醒和管理;法規變動預警;變更管理和申報。
近年來,隨著非洲國家的經濟發展,民眾對基礎醫療服務的需求持續提升,各國政府對於醫療衛生的費用支出也持續增長,非洲醫療衛生市場規模正在不斷擴大。目前非洲大部分國家缺乏本土醫療器械製造業,醫療器械進口依賴度高,這為我國醫療器械企業出海提供了良機。
與此同時,在“一帶一路”倡議不斷向非洲延伸以及中非“八大行動”不斷落實的背景下,中國企業投資非洲醫療器械產業有望迎來更大機遇。
在此背景下,本期文章我們聚焦西非經濟的重要增長引擎——加納,為大家帶來加納醫療器械注冊全流程詳解。
醫療器械產品注冊由加納食品和藥品管理局(Ghana FDA)嚴格把控。若想將醫療器械引入加納市場,企業必須通過加納FDA的認證流程。具體來說,加納醫療器械注冊的要求及流程主要參照以下法規和指南:
1)Public Health Act, 2012——《公共衛生法(2012)》
2)GUIDELINE FOR REGISTRATION OF MEDICAL DEVICE——《醫療器械注冊指南》
3)GUIDELINE FOR IMPORTATION OF MEDICAL DEVICES——《醫療器械進口指南》
在《醫療器械注冊指南》中,加納FDA根據產品風險從低到高,將醫療器械分為Ⅰ、Ⅱ、Ⅲ、Ⅳ四個風險等級。下表列出了醫療器械的四個風險類別,企業可根據示例內容對產品類別進行大致判斷。另外在《醫療器械注冊指南》中,還列出了醫療器械分類的16條具體規則,根據這些規則可以更明確地判斷產品類別。

在《醫療器械注冊指南》中,沒有對各產品類別的注冊路徑進行區分,而是隻分為新的注冊申請、注冊續期的申請及已注冊醫療器械的變更申請三種,注冊時需提交的資料主要包括醫療器械注冊申請表、技術文檔(器械描述和功能、符合安全和性能基本原則的證據、器械規格、設計文件、器械驗證和確認等)、質量管理體係文件、標簽和使用說明書等。

加納境外申請人在加納進行注冊,必須指定當地代理人(local agent),具體要求如下:
1)資質要求:在加納注冊的法人團體;具備申請人的相關授權;有能力代表申請人處理與注冊相關的事宜。
2)代理人職責:監控市場上的器械並承擔法律責任,向加納FDA通報相關問題;促進申請人與加納FDA之間的溝通;處理器械召回;為用戶提供技術支持和服務等。
以上就是我們本期分享的加納注冊相關內容,假如您有加納注冊需求,歡迎隨時聯係我們~金飛鷹可為您提供以下專業服務:
注冊全流程服務:產品分類評估和注冊路徑規劃;資料準備、審核和遞交;與加納FDA直接溝通並及時響應客戶問詢;
本地化支持:依托加納當地戰略合作商資源,為企業提供專業代理人服務,並整合本土資源加速注冊審批流程;
質量管理服務:基於ISO 13485要求的質量管理體係建立和輔導;迎檢準備和現場支持;差距分析和整改建議;
持續合規服務:注冊續期提醒和管理;法規變動預警;變更管理和申報。
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139


