如題,企業如果先對產品進行滅菌送檢,再進行滅菌驗證(保證送檢產品滅菌的參數和滅菌驗證的參數一樣),這樣是否可行?
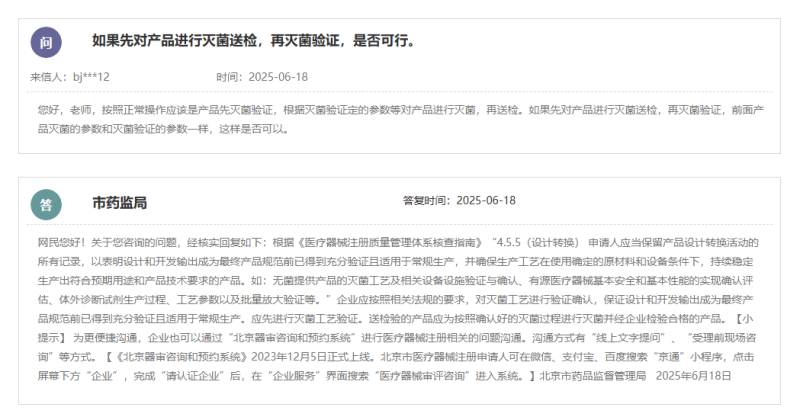
根據北京市藥監局的答複,根據《醫療器械注冊質量管理體係核查指南》“4.5.5(設計轉換) 申請人應當保留產品設計轉換活動的所有記錄,以表明設計和開發輸出成為最終產品規範前已得到充分驗證且適用於常規生產,並確保生產工藝在使用確定的原材料和設備條件下,持續穩定生產出符合預期用途和產品技術要求的產品。如:無菌提供產品的滅菌工藝及相關設備設施驗證與確認、有源醫療器械基本安全和基本性能的實現確認評估、體外診斷試劑生產過程、工藝參數以及批量放大驗證等。”企業應按照相關法規的要求,對滅菌工藝進行驗證確認,保證設計和開發輸出成為最終產品規範前已得到充分驗證且適用於常規生產。應先進行滅菌工藝驗證。送檢驗的產品應為按照確認好的滅菌過程進行滅菌並經企業檢驗合格的產品。
往期精彩推薦
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139


