
近日,FDA發布有關組合產品UDI要求的指南文件草案Unique Device Identifier Requirements for Combination Products,該指南旨在明確醫療器械唯一標識(UDI)要求如何適用於含器械組件的組合產品。指南草案詳細闡述了此類組合產品在UDI標簽要求及全球唯一器械標識數據庫(GUDID)信息提交方麵的監管規定、實施建議和最佳實踐,並通過假設性案例具體說明如何滿足相關UDI合規要求。
該草案提到,如21 CFR第3部分所述,組合產品由兩種或兩種以上不同類型的產品組成(即藥物、器械和/或生物製品的組合)。在組合產品中所包含的每種藥物、器械和生物製品都被稱為該組合產品的組成部分。一般包括單一實體組合產品、共包裝組合產品及交叉標簽組合產品等,相應的UDI要求如下:
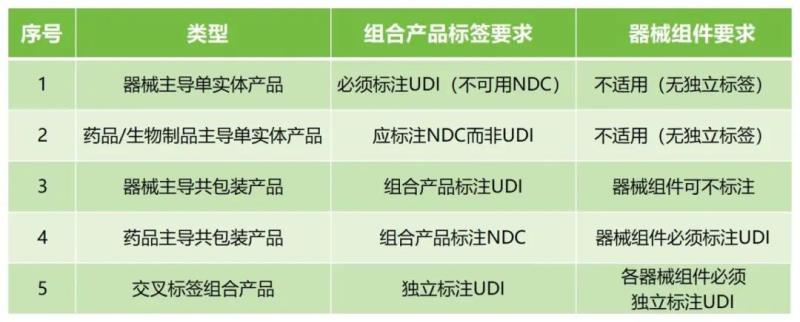
雖說該指南目前仍是一份草案,但明確釋放了FDA對組合產品UDI監管趨嚴的信號,企業需提前布局合規策略,避免因新規實施導致的出口受阻和市場準入延遲。金飛鷹為您提供國內外UDI全流程解決方案,助力企業快速滿足監管要求。立即谘詢,獲取專屬合規方案!
往期精彩推薦
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139


