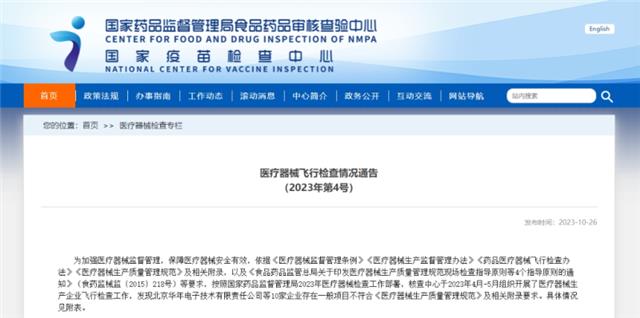
檢查發現一般不符合項10項。
01
設備方麵
1.某關鍵原材料進貨檢驗,企業使用自製工裝無使用記錄,無維護保養記錄,未進行確認和再確認。
2.某關鍵原材料進貨檢驗,企業使用的光譜儀未校準;關鍵中間控製過程,企業使用的2台直流穩壓電源校準範圍未覆蓋實際使用範圍。
02
文件管理方麵
3.企業不能提供某關鍵原材料入廠驗收準則中個別項目參數製定的評估或驗證記錄。
4.企業針對某產品2022年國抽不合格,進行了說明書修訂,但不能提供《設計開發控製程序》規定的該設計更改的需求表和評審記錄。
03
生產管理方麵
5.企業《特殊過程控製程序》中規定“每年對特殊工序進行再確認”,現場查看某特殊工序的相關確認文件,該工藝過程確認報告完成時間為2017年,不能提供2017年後再確認的相關記錄。
6.抽查某批次的產品批生產記錄,未記錄某工藝所采用設備編號、工藝涉及的溫度和時間等內容。
04
質量控製方麵
7.抽查某批次的產品批生產記錄,檢驗記錄中顯示進行了某項檢測,而企業不能提供開展該測試項目要求的相關文件。
05
銷售和售後服務方麵
8.抽查《顧客服務控製程序》文件明確對上市後的產品“售後人員應按定期維護計劃表,開展定期維護服務”,而企業不能提供某產品自2019年上市以來的維護計劃表以及相關記錄。
06
不合格品控製方麵
9.抽查某型號產品的“產品維修記錄表”顯示有4台設備實施了返工維修,但企業不能提供《返工控製程序》規定的針對該4台返工產品的重新驗證記錄。
07
不良事件監測、分析和改進方麵
10.抽查某產品的客戶投訴及相關處理記錄,企業采取返修方式處理,但企業未保留返修的相關記錄。
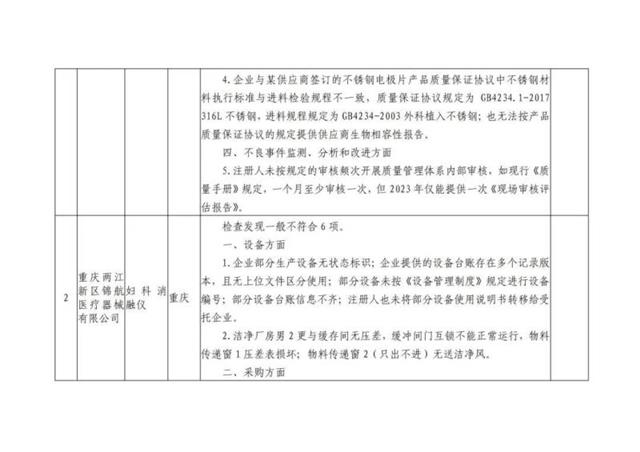
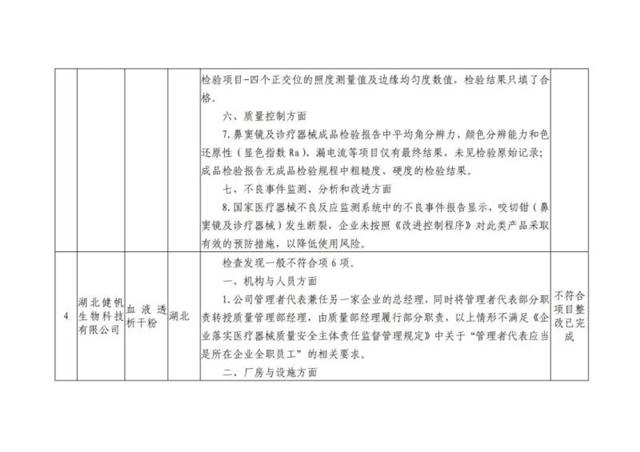
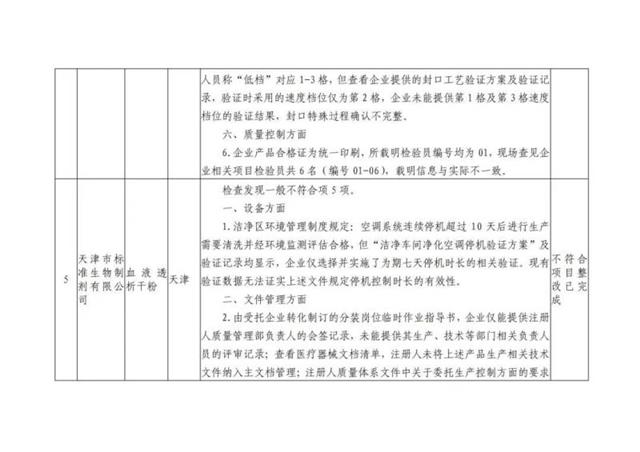
本次“飛檢”的10家企業檢查發現問題具體如下:






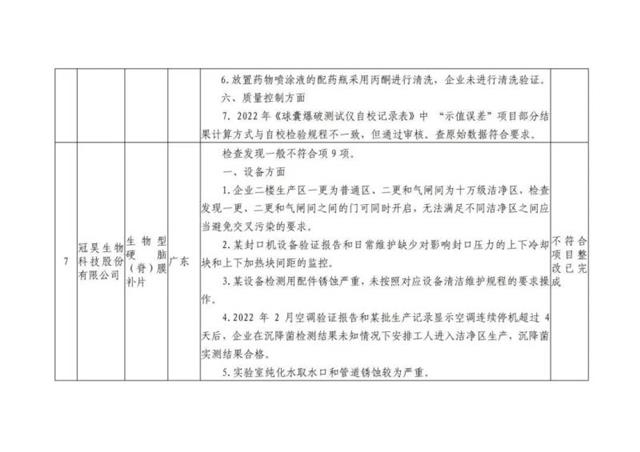






信息來源:國家藥監局食品藥品審核查驗中心
排版整理:金飛鷹藥械
醫療器械注冊谘詢認準金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
湖南:0731-22881823
四川:028 - 68214295

 返回
返回